ニュース
止血の実効性を高める!
大量出血時の輸血対応
「輸血」は医師なら誰でも行うことのできる医療行為ですが、その反面、安易かつ過剰に行われるケースも目立ち、適正輸血が叫ばれています。ここでは、止血目的の輸血療法を実施する際に着目すべき点と実効性のある止血戦略の考え方について解説します。
(山本晃士先生のクリニカルレポートより一部抜粋しています。全文をご覧になりたい方はこちらから>https://form.k3r.jp/atomed/FibCareReport)
大量出血の原因のひとつとなる「凝固障害」
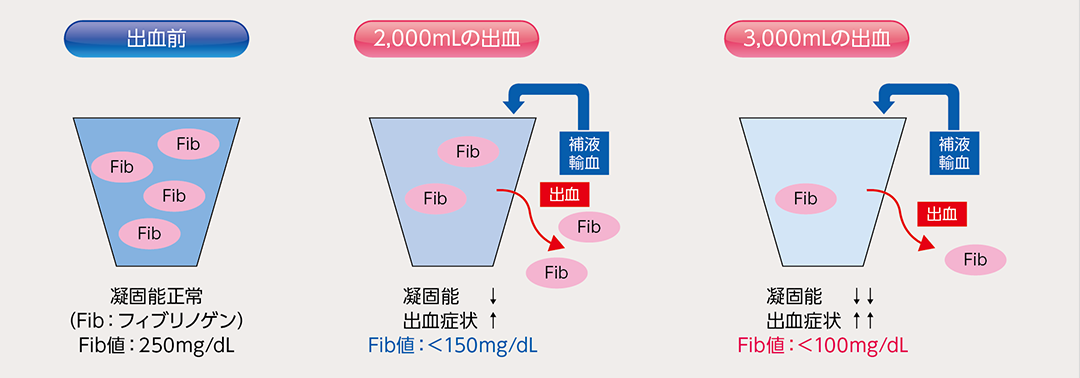
手術中の大量出血の原因として意外と知られていないものに、内科的要因による出血があります。出血部位を特定できない複数箇所から湧き出すように出血(ウージング)し、縫合した部位の針穴からも滲み出すように出血します。このような出血は、出血量の増加によって血小板や凝固因子を体外に喪失し、止血に必要な凝固因子濃度を維持できなくなることで生じます。具体的には、大量出血が起こり補液や赤血球輸血が優先された場合、患者血中の凝固因子が希釈されて血中濃度が低下し、凝固能が落ちてしまいます。これがいわゆる「希釈性凝固障害」です(図1)。希釈性凝固障害に対しては、いかなる外科的処置によっても止血は得られません。
図1
希釈性凝固障害の発症機序
一方、多発外傷や産科大量出血では、止血のためのフィブリン血栓が大量に生成され、著しく凝固因子が消費されることがあります。こうした場合に起こる凝固障害を「消費性凝固障害」と言います。これらの症例では、高度な線溶(血栓溶解)亢進によってフィブリノゲン自体も分解されていくため、加速度的にフィブリノゲン濃度が低下します。
大量出血時の凝固障害の本態は高度な低フィブリノゲン血症だった!
止血に必要な因子のうち、大量出血によって始めに止血可能レベルを下回るのがフィブリノゲンです。止血に必要な最低濃度は健常時の約60%(150mg/dL)と、20~25%でよい他の凝固因子より閾値が相当高く1)、他に代償できる因子もありません(表1)。つまり、それ以外の凝固因子の濃度が十分に保たれていても、フィブリノゲンが足りなければ止血不全を招くことになります(図2)。
表1
止血に必要な最低濃度とそれを招く出血量
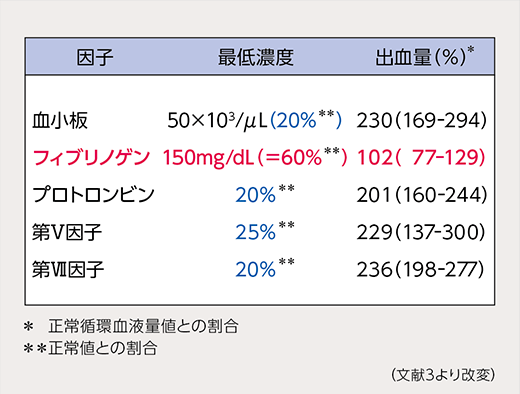
図2
大量出血の止血凝固能を左右するのは血中フィブリノゲン値
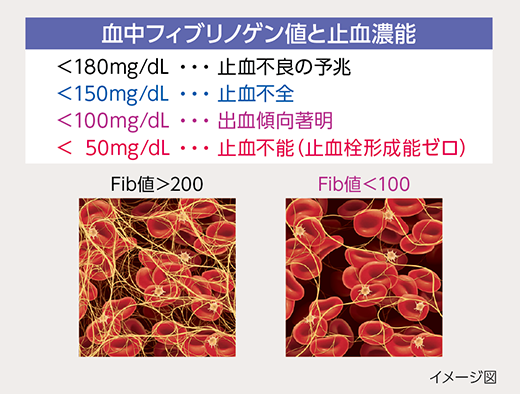
さらに、フィブリノゲンは血小板が凝集・粘着するために必須の凝固因子であるため、血小板数が維持されていてもフィブリノゲン濃度が止血可能レベルを下回っていると止血不全が起こってしまいます。
以上のことから、「大量出血時の凝固障害の本態は、高度な低フィブリノゲン血症である」と言っても過言ではありません。つまり、大量出血の際にターゲットとすべき因子は、検査上も治療上もフィブリノゲンということになります2-4)。近年は、大量出血に関するガイドラインや指針の中で、止血能評価および治療開始の指標としてフィブリノゲン値が重要視されてきています4,5)。
POCTを用いてタイムリーなフィブリノゲン値測定を
凝固検査の結果を参考に止血のための輸血治療を実施することが理想ですが、一般的には、凝固検査の結果が報告されるまでに約30~60分かかります。毎分100~150mLの出血が続く大量出血の症例もあるため、凝固検査は10分以内に評価できることが望まれます。上記の通り、凝固障害の主因は低フィブリノゲン血症であることから、止血凝固能の評価では迅速なフィブリノゲン値測定が最も重要と言えます。
そこで注目されているのが、Point of Care Testing(POCT)、つまりベッドサイドで実施できるフィブリノゲン検査です。本邦においてもリアルタイムでフィブリノゲン値を測定できる小型の迅速検査機器が発売されており、手術室、分娩室、救命救急センターなど臨床現場に導入されはじめています。以下に、産科大量出血症例を示します(図3)。
図3
重症羊水塞栓症例における治療経過と検査値の推移
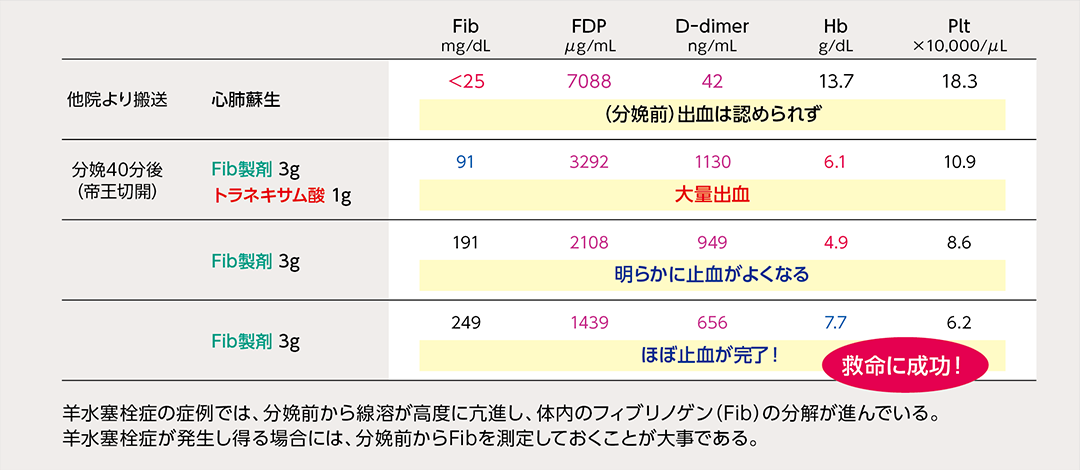
大量出血時には「POCT」と「濃縮フィブリノゲン投与」
治療に直結する検査をベッドサイドで実施するPOCTシステムの導入により、大量出血患者など重篤な凝固障害を呈している患者において、よりタイムリーで実効性の上がる止血目的の輸血治療が可能になると期待されます6-9)。すでに米国の胸部外科学会や心臓血管麻酔学会では、POCTシステムに基づいた各種血液製剤の使用を推奨しています。
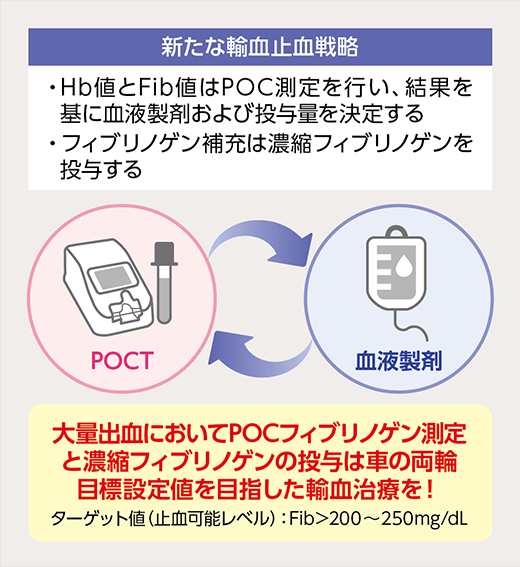
ただ、忘れてはならないのは、せっかく低フィブリノゲン血症の程度をリアルタイムで評価できても、それに対して実効性の上がる輸血用製剤、すなわち濃縮フィブリノゲンを使えなければ意味がないということです。「POCT」と「濃縮フィブリノゲン」を両輪として活用することが、大量出血患者の止血、ひいては救命~予後改善にとって非常に重要だと言えます(図4)。
図4
大量出血時の輸血治療〜そのエッセンス〜
まとめ
- 凝固因子の中で、大量出血によって初めに止血可能レベルを下回るのがフィブリノゲン。他に代償できる因子はない。
- 低フィブリノゲン血症(Fib<150mg/dL)では、濃縮フィブリノゲンを迅速に短時間で投与する必要がある。
- 大量出血症例においては、POCTフィブリノゲン測定と濃縮フィブリノゲンの投与は車の両輪。
目標設定値(Fib>200-250mg/dL)を目指した輸血治療を実施することが重要。
関連記事はこちら
関連記事:止血目的の輸血ではどう使い分ける?血液製剤の種類と特徴

埼玉医科大学総合医療センター
輸血細胞医療部
教授山本 晃士先生
プロフィール
名古屋大学医学部卒業後、名古屋大学大学院医学研究科にて先天性プロテインC欠乏症、米国 サンディエゴ・スクリプス研究所にて線溶阻害因子PAI-1発現異常と病態に関する研究を行う。
2015年に埼玉医科大学総合医療センター輸血細胞医療部教授に就任し、現在に至る。
研究専門分野
- 出血性疾患および血栓性疾患の分子病態と臨床
- 凝固障害に対する輸血治療
著書
- 2016年 POCTを活用した実践的治療~輸血による止血戦略とそのエビデンス(金芳堂)
- 2018年 Dr.山本の「この一冊で血栓症がとことんわかる!」(中外医学社)
- 2021年 Dr.山本の「出血検査・治療の当たり前を疑え!」(中外医学社)
参考文献
(1) Hiippala ST, Myllylä GJ, Vahtera EM. Hemostatic factors and replacement of major blood loss with plasma poor red cell concentrates. Anesth Analg. 1995;81:360-365.
(2) 山本晃士.大量出血(希釈性凝固障害)に対する輸血療法.医学のあゆみ「周術期輸血療法UPDATE」.2008;224:205-209.
(3) Levy JH, Szlam F, Tanaka KA, et al. Fibrinogen and hemostasis:a primary hemostatic target for the management of acquired bleeding. Anesth Analg. 2012;114:261-274.
(4) Levy JH, Welsby I, Goodnough LT. Fibrinogen as a therapeutic target for bleeding:a review of critical levels and replacement therapy. Transfusion. 2014;51:1389-1405.
(5) Kozek-Langenecker SA, Ahmed AB, Afshari A, et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology: First update 2016. Eur J Anaesthesiol. 2017;34:332-395.
(6) Meybohm P, Zacharowski K, Weber CF. Point-of-care coagulation management in intensive care medicine. Crit Care. 2013;17:218.
(7) Johansson PI, Stensballe J, Oliveri R, et al. How I treat patients with massive hemorrhage. Blood. 2014;124:3052-3058.
(8) Karkouti K, Callum J, Wijeysundera DN, et al. Point-of-care hemostatic testing in cardiac surgery:A stepped-wedge clustered randomized controlled trial. Circulation. 2016;134:1152-1162.
(9) Weber CF, Görlinger K, Meininger D, et al. Point-of-care testing: a prospective, randomized clinical trial of efficacy in coagulopathic cardiac surgery patients. Anesthesiology. 2012;117:531-547.